共计 2480 个字符,预计需要花费 7 分钟才能阅读完成。
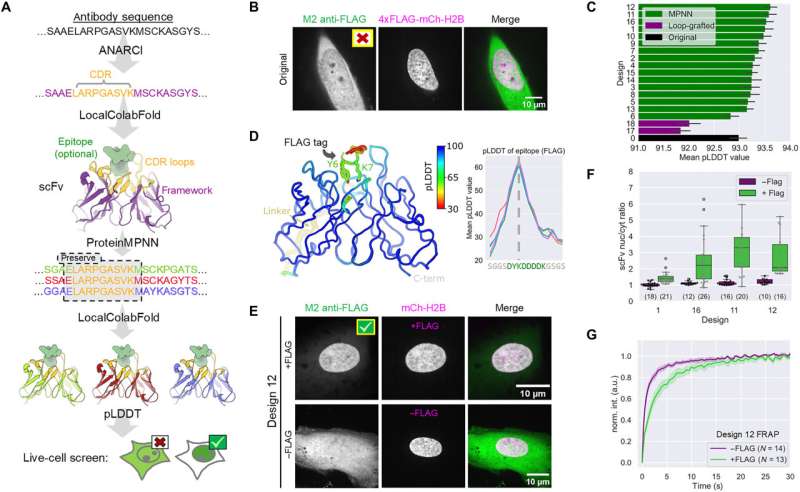
将抗体序列转化为功能性胞内抗体的流程。图片来源:《科学进展》(2026 年)。
科罗拉多州立大学的研究人员开发出一种利用人工智能改造抗体的新方法,使其能在活细胞内“发光”,如同灯泡一般照亮细胞内部的微观世界。这项技术有助于科学家更清晰地追踪可能导致癌症等疾病的基因表达异常。该研究发表于《科学进展》期刊,其介绍的方法在速度上远超传统手动测试与开发流程,旨在解决长期困扰科学界的难题——如何持续观察活细胞内瞬息万变的生命活动。以往的技术局限,限制了对 DNA 转录和蛋白质合成等关键细胞过程的基本理解,而这些被称为基因表达的过程,正是解开人类健康与疾病诸多谜题的核心。
挑战的根源在于细胞核内的复杂环境。DNA 紧密缠绕在组蛋白上,而组蛋白所携带的微小化学修饰标签,如同控制基因开关的“交通信号灯”,动态地决定基因的开启或关闭。为了追踪这些变化,科学家曾尝试使用抗体作为分子“探针”去结合细胞内靶点。然而,抗体天然存在于血液中,一旦进入活细胞内部复杂且拥挤的环境,极易发生错误折叠、聚集并失去功能。此外,传统上筛选出适用于此目的的抗体,往往需要耗费数年时间进行大量试错。
科罗拉多州立大学的跨学科团队利用人工智能技术,成功突破了这一瓶颈。他们能够快速将具有潜力的抗体重新设计为“胞内抗体”。这类经过工程化改造的抗体片段,被专门设计为能在细胞内正确折叠、保持可溶性与稳定性。当为其标记上特殊的荧光分子后,这些探针便能实时、动态地显示特定的组蛋白修饰及其化学关联。该研究的主要作者、生物化学与分子生物学系副教授蒂姆·斯塔塞维奇比喻道:“你可以把这些胞内抗体探针想象成小灯泡,它们能帮助我们更好地观察那些赋予细胞身份、决定其功能的活动。”“这些探针最终可能为癌症研究提供关键信息,”他进一步解释,“例如,揭示哪些错误基因被异常激活,或者为何本应开启的肿瘤抑制基因却处于关闭状态。”“通过使用这些探针,研究人员能够分辨出是个别细胞出现问题,还是更大范围的细胞群体发生了故障。这项工作提供了一种全新工具,让我们能够以以往不可能的方式观察分子间的相互作用和细胞的激活状态。”斯塔塞维奇补充说,与传统技术提供的静态“快照”相比,这些探针使科学家得以观看生命过程的“动态影像”,从而不会错过那些转瞬即逝的关键时刻。
AI 辅助蛋白质设计:快速打造细胞内的“探照灯”
这项研究是运用人工智能技术深入理解活细胞运作这一大趋势的一部分。在该项目中,研究团队借助 Google DeepMind 的 AlphaFold2 和 ProteinMPNN 等软件工具,快速识别并重新设计了一批潜在有用的抗体蛋白序列(这些序列通过与东京科学研究所的合作获得),将其转化为稳定的胞内抗体。人工智能程序能够预先识别出那些更可能“行为良好”的抗体靶点,这为团队提供了巨大优势。他们仅需测试大约五种候选设计,就能获得一种可用的探针方案。相比之下,以往一名博士生可能需要在单一选项上耗费数年心血,且结果毫无保障。该团队的方法建立在生物医学与化学工程学院克里斯·斯诺教授已有的工作基础上,斯诺教授利用 AI 加速蛋白质工程的研究,他也是本论文的作者之一。
总体而言,团队成功创建了 19 种新型的基于抗体的探针。这些探针在高温下仍能保持功能,且更易于生产用于实验测试。尤为值得注意的是,这 19 种序列中有 18 种在通过 AI 驱动流程优化之前都曾宣告失败,这强有力地证明了该方法的有效性。团队还指出,他们在流程中遇到的失败案例与成功案例同样具有价值,因为它们揭示了蛋白质结构中哪些改造模式和氨基酸替换是有效的,为未来的探索指明了方向。论文第一作者、博士生加布里埃尔·加林多表示,在项目期间,团队将传统抗体成功转化为胞内抗体的总体成功率约为 70%。“这显然远高于之前观察到的 5% 至 10% 的成功率,非常令人鼓舞,”加林多说,“我们期待看到其他新开发的 AI 工具,如 AbMPNN、IgMPNN 和 AntiFold,如何通过整合更多抗体特异性数据,来进一步改善抗体的结构预测与设计。”斯塔塞维奇表示,一个持续的目标是帮助开发一个大型数据库,用作训练集,以进一步完善 AI 软件识别和设计目标序列的算法。“这项工作的潜力是惊人的,”斯塔塞维奇说,“目前已有超过 2000 个已解析的抗体结构和 14.7 万个公开可用的序列——每一个都有可能通过我们的方法转化为有用的胞内抗体。而且这个数字还会持续增长。”
本科生格雷琴·菲克森是生物化学与分子生物学系的学生,也是斯塔塞维奇实验室中此项研究的作者之一。她在加林多的指导下,参与了多种潜在胞内抗体的设计,并验证了它们的功能和效率。她表示,这个项目通过将课堂理论与实验室的实际工作联系起来,提升了她的学术能力。“我从这项已发表的工作中学到的最重要一课,是学会了如何整合不同的科学概念与方法,以获得更深入的生物学见解,并突破技术可能性的边界,”目前正在海德堡大学攻读研究生的菲克森说道。
未来应用:从癌症到病毒追踪
该研究的合著者、布莱恩·盖斯教授认为,这种方法在解决病毒学领域的类似问题上拥有巨大潜力。他在微生物学、免疫学和病理学系的团队主要研究西尼罗河病毒等如何复制并影响宿主细胞。通过将病毒特异性的抗体重新设计为探针,他希望实时追踪病毒蛋白在细胞内的动态分布,从而以前所未有的细节理解感染过程。“使用病毒特异性抗体的传统固定细胞显微镜技术,长期以来一直用于观察病毒蛋白,但这种方法只能捕捉时间快照,无法显示单个蛋白质在感染过程中的实时移动情况,”盖斯解释道。“我们的新方法有望帮助我们理解这些病毒蛋白如何从一开始就影响病毒复制,并在此过程中如何改变细胞环境。”他补充说,该团队现在处于一个绝佳的位置,能够实时监测西尼罗河病毒的组装与成熟过程,并亲眼“看到”病毒颗粒的形成。
斯塔塞维奇指出,新探针的优异耐久性也带来了其他应用机会。“例如,它们的坚韧特性可能使其非常适合用于诊断试剂。而且由于即使在高温下也能保持稳定,它们可以轻松地在各种条件下运输和储存,”他解释道。“我们的方法展示了大量潜在的探索途径,未来深入挖掘这些可能性将令人无比兴奋。”


